摘要
背景
慢性炎症性肺病(如支气管扩张)的气道炎症部分是由中性粒细胞衍生丝氨酸蛋白酶(NSP)/抗蛋白酶失衡介导的。nsp在骨髓中性粒细胞形成过程中被组织蛋白酶C (CatC;DPP1)。因此,CatC是一个有吸引力的靶点,可以降低支气管扩张患者肺部NSP活性,恢复蛋白酶/抗蛋白酶平衡。我们报告了新型CatC抑制剂BI 1291583的临床前药理学评估结果。
方法
采用表面等离子体共振法测定了BI 1291583与人CatC的结合动力学。通过CatC特异性荧光法测定体外对人CatC活性的抑制作用,并评估对相关组织蛋白酶和不相关蛋白酶的选择性。在人中性粒细胞祖细胞系中评估了NSP中性粒细胞弹性酶(NE)产生的抑制作用。在小鼠模型中研究了脂多糖(LPS)刺激和BI 1291583分布对支气管肺泡灌洗液(BALF)中性粒细胞NE和NSP蛋白酶3 (PR3)的体内抑制作用。
结果
BI 1291583以共价、可逆的方式结合人CatC,选择性和完全抑制CatC酶活性。在小鼠体内lps刺激模型中,这种抑制作用转化为U937细胞中NE活化的浓度依赖性抑制,以及对BALF中性粒细胞中NE和PR3活性的剂量依赖性几乎完全抑制。与血浆相比,BI 1291583在靶组织骨髓中的暴露量高达100倍。
结论
BI 1291583介导的CatC抑制有望恢复慢性气道炎性疾病(如支气管扩张)患者肺部蛋白酶-抗蛋白酶平衡。
背景
支气管扩张是一种由多种潜在临床疾病引起的下呼吸道疾病[1]。潜在的病因范围从特征明确的遗传疾病,如囊性纤维化(CF)和原发性纤毛运动障碍,到哮喘、慢性阻塞性肺病和感染后后遗症以及各种自身免疫性疾病。然而,最大的单一病因是特发性支气管扩张,其根本原因尚不清楚[1]。虽然单独考虑的每种潜在病因可能很少见,但综合考虑,支气管扩张的发生率高达每10万人94.8人(0.1%)[2],随着年龄和女性的增加而增加[3]。患病率不断上升,支气管扩张已被描述为一种新兴的全球流行病[4,5]。
支气管扩张的特征是支气管异常、瘢痕化和不可逆扩张[6]。发病机制尚不完全清楚;然而,一旦确定,患者表现出慢性炎症,感染,粘膜纤毛清除受损和进行性结构性肺损伤的证据。这些特征之间复杂的相互作用(所谓的“恶性漩涡”)导致肺功能恶化和下降,并伴有相关的发病率和死亡率[1]。
中性粒细胞炎症是支气管扩张的中心特征,其程度与疾病的严重程度和进展有关[7,8]。从中性粒细胞释放炎症效应因子有助于肺部的炎症环境[9],中性粒细胞衍生丝氨酸蛋白酶(NSPs;中性粒细胞弹性酶[NE]、蛋白酶3 [PR3]和组织蛋白酶G [CatG])及其内源性抑制剂在慢性炎症性呼吸系统疾病(包括支气管扩张)患者中有文献报道[10,11,12,13,14]。这种不平衡已被证明会损害对细菌感染的防御,损害粘膜纤毛的清除,促进粘液分泌过多,并降解弹性蛋白和其他细胞外基质成分[10,15]。在体外实验中,NE已被证明可以抑制纤毛功能和粘膜纤毛清除,并促进粘液分泌,痰液中NE的活性与疾病严重程度、气道细菌定植易感性增加、病情恶化风险/频率增加、住院和死亡率增加有关[16,17,18,19]。与病情稳定的患者相比,支气管扩张患者在加重期痰中PR3水平升高(即不在加重期)[20]。此外,PR3浓度与痰中NE水平相关[20]。CatG参与支气管扩张的发病机制,导致气道上皮破坏和纤毛细胞功能障碍[21]。与对照组相比,在支气管扩张患者中观察到CatG活性增加,并且CatG活性随着疾病严重程度的增加而增加[21]。
NE、PR3和CatG被组织蛋白酶C (CatC;也被称为二肽基肽酶1)在骨髓中性粒细胞的骨髓形成过程中[22]。在中性粒细胞祖细胞中,这些NSPs被合成为前原酶,被运输到溶酶体,在那里它们被切割成前酶,最后被CatC去除一个前肽激活成活性成熟酶,并储存在酸性条件下(pH 4-5);非活化的NSPs在成熟的中性粒细胞从骨髓中释放出来之前就被降解了[10,22]。因此,骨髓中CatC的抑制预计会导致循环中性粒细胞减少,活跃的NSPs水平被招募到慢性炎症性肺病(如支气管扩张)患者的肺部。反过来,这有望减少肺弹性蛋白和结缔组织的酶降解对远端气道的破坏;可能的继发性抗炎和抗粘液高分泌作用也被预期[18,23,24,25]。
目前可用的治疗支气管扩张的方法,如抗生素、解黏液剂和抗炎药,都只是对症治疗,没有药物被许可用于治疗潜在的病理生理,迄今为止唯一基于证据的干预措施是胸部清除[26,27]。此外,在许多情况下,抗生素治疗不足以控制感染,甚至在没有感染的情况下,炎症也会发展[28]。因此,迫切需要一种新的治疗方法,打破嗜中性粒细胞炎症的恶性漩涡,防止恶化并改善症状。基于上述生物学,CatC的抑制有望具有这种潜力。第一个证据来自CatC抑制剂brensocatib(原AZD7986),该药物目前处于支气管扩张的3期开发(NCT04594369)[29]。BI 1291583是一种新型的、高效的、选择性的CatC抑制剂,正在研究作为支气管扩张患者的潜在疾病改善疗法。在这项研究中,我们报告了BI 1291583的临床前体外和体内药理特征。
方法
下面是对这些方法的简要总结。有关详细方法,请参见附加文件1。使用GraphPad Prism软件(Windows版本9.5.0,GraphPad software, www.graphpad.com)生成所有数据的图形表示。
BI 1291583与人CatC结合动力学
采用Biacore T200系统,采用表面等离子体共振法对BI 1291583与人CatC的结合动力学进行了评价。使用标准程序将活化的人CatC固定在CM5芯片上。将BI 1291583浓度(0.08、0.4、2、10和50 nM)在pH为4.5的条件下注射到固定靶上。使用Biacore T200评价软件,1.0版,2010,计算三个个体实验的平均关联速率常数(kon)和解离速率常数(koff)值。平衡解离常数KD由koff/kon计算,半衰期t1/2由ln2/koff计算。
体外抑制重组人组织蛋白酶酶活性的研究
通过组织蛋白酶C、K、L(重复实验)和F、B、H、S(单次实验)的荧光底物转化,测定BI 1291583存在下重组人组织蛋白酶的活性。活化的组织蛋白酶用连续稀释的BI 1291583孵育,然后加入荧光组织蛋白酶底物。加入抑制剂化合物停止反应,用Envision Reader在激发波长355nm,发射波长460 nm处测量荧光水平,以载体对照作为非抑制酶活性的参考,以抑制剂作为背景荧光的对照。BI 1291583介导的组织蛋白酶抑制导致的荧光变化是通过计算BI 1291583存在时的荧光与减去背景荧光后的对照物荧光的百分比来确定的。利用GraphPad Prism软件(Windows 9.5.0版本,GraphPad software, www.graphpad.com)计算BI 1291583抑制组织蛋白酶50%活性的浓度(IC50),并进行非线性回归拟合。
中性粒细胞祖细胞系活性NE产生的抑制作用
用重复实验研究了BI 1291583对人骨髓细胞系U937产生活性NE的抑制作用。使用U937细胞,因为它们组成性地表达和加工NE。此外,使用髓系细胞系而不是原代中性粒细胞,因为CatC在骨髓形成过程中激活骨髓中的NSPs,一旦中性粒细胞进入血液,就不会进一步激活;因此,CatC抑制的作用不能在原代中性粒细胞中进行研究。BI 1291583分别以0.064、0.32、1.6、8、40、200和1000 nM的终浓度加入细胞悬液中。然后将细胞孵育48小时。然后根据制造商的说明,使用CellTiter-Glo®发光细胞活力测定法在重复实验中测量细胞活力。为了测量NE活性,通过离心分离细胞,裂解并去除碎片。通过荧光底物的转化来测定NE的活性。在360 nm激发波长和460 nm发射波长下,用SpectramaxM5荧光读取器测量荧光随时间的增加。以BI 1291583在CatC完全饱和时的反应速率为主要读数,计算NE的活性。计算BI 1291583处理的裂解物中NE活性的抑制百分比,相对于纯对照的平均值。使用GraphPad Prism软件(Windows版本9.5.0,GraphPad software, www.graphpad.com)计算IC50,采用非线性回归曲线拟合。
在相同条件下,研究了INS1007 (brensocatib的活性成分)对活性NE产生的抑制作用(见方法,附加文件1)。
体内抑制活性NE、CatG和PR3的产生
为了证明BI 1291583阻断活性NSPs产生的能力,我们在小鼠(雌性Crl:NMRI小鼠[每治疗组n = 6只])中建立了体内机制验证模型,并进行了两种给药计划。在第一个为期2天的治疗假期方案中,小鼠在第1-5天、第8天和第9天每天口服两次,分别给予0.005、0.05、0.5或5 mg/kg BI 1291583或对照物。在第10天,给予最后剂量的BI 1291583或载体,然后用雾化的大肠杆菌脂多糖(LPS)刺激,以诱导中性粒细胞流入肺部。在第二给药方案中,小鼠分别以0.00005、0.0001、0.001、0.01、0.03、0.1、0.5或5 mg/kg BI 1291583或载药,每天1次灌胃,连续11天。在第12天,给予最后剂量的BI 1291583或载体,然后进行LPS攻击。
LPS攻毒4个半小时后,经气管插管灌洗收集肺中性粒细胞,测定中性粒细胞计数。然后将支气管肺泡灌洗液(BALF)样品离心,用溶解缓冲液的体积使中性粒细胞计数正常化,裂解细胞颗粒。在360 nm激发波长和460 nm发射波长下,利用SpectramaxM5荧光读取器对荧光底物进行转换,测定NE、CatG和PR3的活性。将荧光值归一化为中性粒细胞计数,并计算BI 1291583处理动物的NE、CatG和PR3平均活性,相对于LPS/载体处理的对照动物的平均值。在每个剂量组的合并样本中测量CatG和PR3的活性。在11天的给药实验中,使用GraphPad Prism软件(Windows版本9.5.0,GraphPad software, www.graphpad.com)计算BI 1291583抑制50% NE活性(ED50)的剂量,并采用非线性回归曲线拟合。根据回归曲线ED99 = 99(1/斜率)× ED50计算NE活性(ED99)抑制99%的剂量。采用单因素方差分析和Dunnett多重比较检验分析确定统计学显著性。
最后一次给药BI 1291583后5 h,用纳可伦(400-600 mg/kg腹腔注射)安乐死动物。为了评估BI 1291583在血浆中的暴露,取了5滴球后血。股骨经提取、震荡冷冻于液氮中,保存于- 20°C,直到骨髓制备完成。为了制备骨髓,骨骺被切断,骨髓从骨干中提取。通过液相色谱-串联质谱法测定暴露量。
在与11天给药方案相同的条件下,研究了INS1007对活性NE产生的抑制活性,以及INS1007在骨髓和血浆中的分布(见方法,附加文件1)。
Selec不相关蛋白酶的活性分析
BI 1291583(10µM)对来自不同类别的一组不相关蛋白酶的抑制和刺激活性通过酶测定进行评估,适当时使用经过验证的荧光或光度法技术。效果计算为每个蛋白酶的对照抑制剂的百分比抑制(正值)或刺激(负值)。低于25%的抑制或刺激被认为是不显著的,25-50%被认为是弱至中度的,大于50%被认为是显著的。实验重复进行,结果以平均值表示。
目录
摘要背景
方法
结果
讨论
结论
数据可用性声明
缩写
参考文献
致谢
作者信息
道德声明
补充信息
搜索
导航
#####
结果
BI 1291583以可逆的方式结合人CatC
BI 1291583结合的重组人CatC在pH值为4.5时的平均kon和koff值分别为6.36 × 106 M−1 s−1和2.29 × 10-3 s−1,KD值为0.43 nM。平均t1/2为5.19分钟。动力学参数总结于附加文件1:表AF1。
BI 1291583选择有效抑制体外人CatC酶活性
人CatC被抑制的平均IC50为0.9 nM(图1),对其他相关半胱氨酸蛋白酶具有高选择性(组织蛋白酶K的IC50值从6695 nM到组织蛋白酶B、F和H的IC50值大于100,000 nM)(表1)。大鼠和小鼠的CatC被抑制的效力相似(平均IC50值分别为1.2 nM和0.6 nM)。
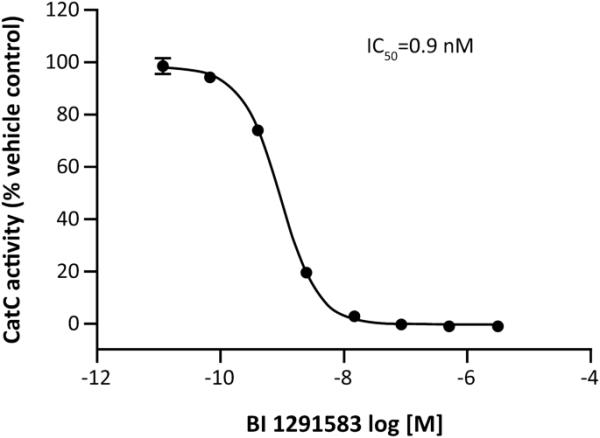
BI 1291583对重组人CatC的抑制作用CatC组织蛋白酶C, IC50浓度BI 1291583导致50%的组织蛋白酶C酶活性抑制。数据是平均的。误差条表示重复实验的标准差
BI 1291583不抑制或刺激其他不相关的蛋白酶
在10µM下,未检测到来自四种不同类别的33种不相关的蛋白酶的相关抑制或刺激(附加文件1:表AF2)。
BI 1291583抑制中性粒细胞祖细胞系活性NE的产生
BI 1291583以浓度依赖的方式抑制中性粒细胞祖细胞U937中活性NE的产生,平均IC50为0.7 nM,对细胞活力无影响(BI 1291583在所有浓度下的细胞活力> 93%,在最高浓度[1000 nM]下的平均细胞活力为98%)(图2)。
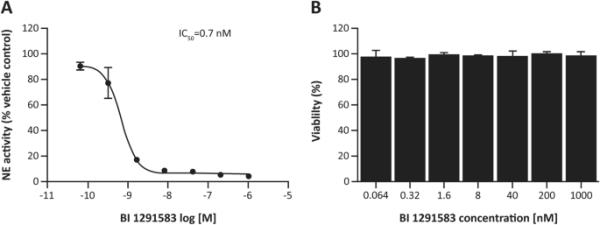
A BI 1291583对U937细胞活性NE产生的抑制作用及B对细胞活力的影响ib1291583的IC50浓度导致中性粒细胞弹性酶活化50%的抑制,NE中性粒细胞弹性酶。数据是平均的。误差条表示重复实验的标准差
BI 1291583在体内抑制活性NE、PR3和CatG的产生
在小鼠lps刺激模型中评估体内疗效。在为期2天的治疗假期方案中,BI 1291583以剂量依赖性的方式抑制小鼠BALF中性粒细胞活性NE的产生,抑制率最高可达97%。在NE分析中,仅用载体处理动物的BALF中性粒细胞裂解物,每天两次剂量分别为0.005、0.05、0.5和5 mg/kg BI 1291583,每105个中性粒细胞产生的平均(平均[SEM]的标准误差)荧光信号分别为2118.1(132.3)、1008.3(176.5)、458.1(165.0)、81.1(57.3)和62.9(46.8)相对荧光单位(RFU)。这些值转化为显著(p < 0.001) 44%(8.3%), 75%(7.8%), 96%(2.7%)和97%(2.2%)的抑制作用(附加文件图AF1, A部分)。计算出1.5 mg/kg时NE抑制的ED99值。在CatG分析中,与单独处理相比,单独处理和0.005,0.05,0.5和5 mg/kg BI 1291583的Vmax值分别为0.79,0.28,0.05,0.01和0.01/105中性粒细胞,转化为65%,94%,99%和99%的抑制(附加文件图AF1, B部分)。
用BI 1291583治疗11天对lps诱导的中性粒细胞流入肺没有影响,但几乎完全(99%)以剂量依赖的方式抑制活性NE的产生。在NE分析中,仅用载体处理动物的BALF中性粒细胞裂解物,每日剂量分别为0.1 mg/kg、0.5 mg/kg和5 mg/kg BI 1291583,每105个中性粒细胞产生的平均(SEM)荧光信号分别为1419.2(198.3)、147.8(87.5)、27.0(16.9)和15.5(4.6)相对荧光单位(RFU)。这些值转化为显著的(p < 0.001) 90%(6.2%), 98%(1.2%)和99%(0.3%)的抑制作用(图3)。NE抑制的ED50值计算为0.03 mg/kg, ED99计算为0.3 mg/kg(图4)。对于PR3分析,仅载体和0.1,0.5和5 mg/kg BI 1291583的值(SEM)分别为182(47.5),19(0),13.5(1.5)和10 (1.0)RFU/105中性粒细胞,转化为显著的平均值90%(0%)。与单药治疗相比,抑制率分别为93%(0.8%)和94%(0.6%)(均p < 0.001)(图5)。
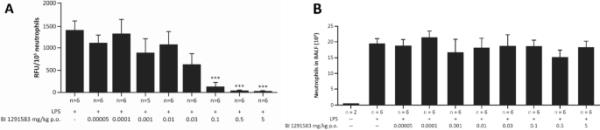
BI 1291583对LPS攻毒后小鼠BALF中性粒细胞裂解液中A - NE活性和BALF中B绝对中性粒细胞数量的影响支气管肺泡灌洗液,LPS脂多糖,NE中性粒细胞弹性蛋白酶,口服,RFU相对荧光单位。***与载具比较p < 0.001。数据是平均的。误差条表示平均值的标准误差
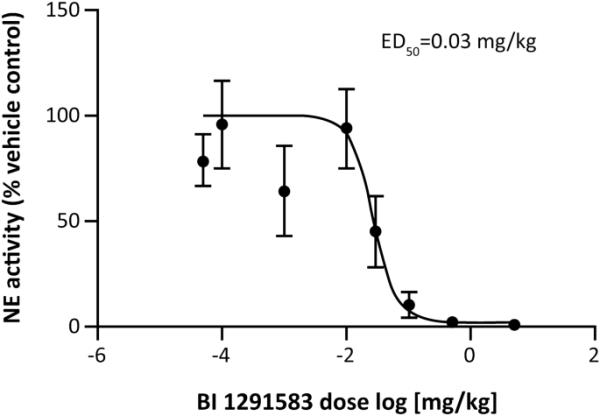
BI 1291583治疗后小鼠BALF中性粒细胞裂解液中活性NE产生抑制的剂量反应和随后的LPS刺激,给药11天。ED50有效剂量,抑制50%活性中性粒细胞弹性酶,NE中性粒细胞弹性酶的产生。数据是平均的。误差条表示平均值的标准误差
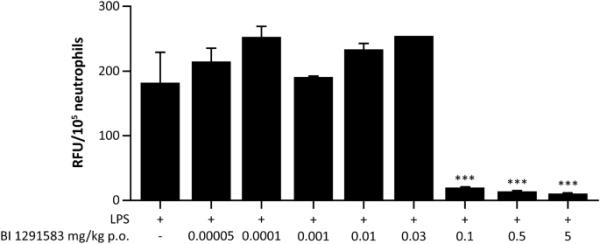
BI 1291583治疗后小鼠BALF中性粒细胞裂解液中PR3的活性和随后的LPS刺激,给药11天。支气管肺泡灌洗液,LPS脂多糖,口服,RFU相对荧光单位,PR3蛋白酶3。***与载具比较p < 0.001。收集样本进行PR3活性分析。数据是平均的。误差条描述了重复实验中平均值的标准误差
BI 1291583优先分布于骨髓
在2天治疗假期方案的第10天,BI 1291583最后剂量后约5小时,骨髓中BI 1291583以0.5 mg/kg的平均(SEM)暴露量为2981.7 (185.0)nM。在血浆中,相应值为32.5 (2.1)nM。这相当于骨髓与血浆的暴露比约为92(附加文件图AF2)。
在11天给药方案的第12天,BI 1291583末次给药后5小时,骨髓中有效剂量(0.1、0.5、5 mg/kg)的BI 1291583平均(SEM)暴露量分别为428.5 (83.6)nM、1973.2 (908.9)nM和11092.0 (3287.5)nM。血浆中相应值分别为3.5 (0.4)nM、24.2 (1.6)nM和342.8 (24)nM。这相当于骨髓与血浆的暴露比分别为122、82和32(图6)。
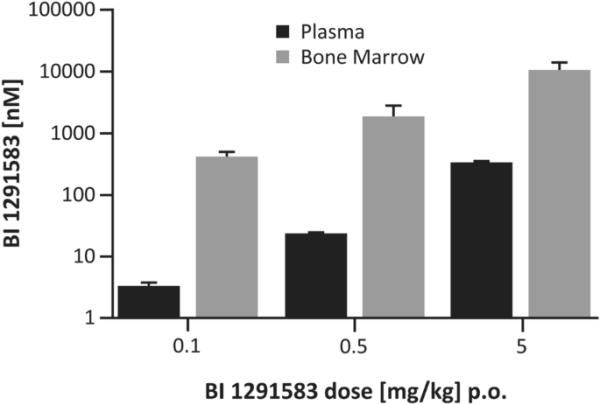
bi1291583给药后5小时的骨髓和血浆分布,给药11天。口头。数据是平均的。误差条表示平均值的标准误差
研究INS1007对U937细胞和小鼠lps刺激模型中活性NE产生影响的实验结果,以及对其在骨髓和血浆中的分布分析,可在附加文件1中找到。
讨论
在这项全面的临床前分析中,我们证明BI 1291583是一种有效的选择性CatC抑制剂。利用SPR数据,我们可以证明BI 1291583以可逆的方式与人类CatC结合。与一组相关的组织蛋白酶相比,它完全抑制了人重组CatC,选择性大于6000倍,此外对不同类别的不相关蛋白酶没有相关的抑制或刺激。我们在小鼠和大鼠CatC中也证明了类似的效力。然后,我们能够证明BI 1291583具有相关的下游效应,剂量依赖性地抑制中性粒细胞祖细胞系中活性NE的产生,而对细胞活力没有影响。最后,在2天的治疗假期方案中,我们证明BI 1291583剂量依赖性地抑制了BALF中性粒细胞中活性NE和CatG的产生,分别高达97%和99%。在11天的连续给药模型中,我们还证明BI 1291583对活性NE和PR3的抑制作用分别高达99%和94%。在有效剂量下(对NSPs有统计学显著抑制的剂量),BI 1291583分布到骨髓靶室的暴露量是血浆暴露量的100倍,这一特性可能有助于降低由于患者骨髓外CatC抑制而产生的副作用风险。
很少有CatC抑制剂达到临床试验的水平,只有另外两种化合物仍在支气管扩张的临床开发中。HSK31858是一种CatC抑制剂,目前正在非cf支气管扩张患者的2期临床试验中进行评估(NCT05601778)。Brensocatib(原AZD7986)是一种口服、可逆的CatC抑制剂,目前处于支气管扩张患者的3期开发阶段(NCT04594369)。在i期研究中,健康志愿者被随机分配至brensocatib (40mg)或安慰剂(28天),每日一次,随访1个月[30]。暴露相关的NE活性降低已被证实,具有普遍耐受良好的安全性;然而,也观察到一些剂量依赖性的、可能与catc相关的非严重皮肤表现(角质脱落和角化过度)[30]。在随后的2期试验中[31],在过去一年中至少有两次发作的支气管扩张患者被随机分配到每天一次剂量的10 mg或25 mg brensocatib或安慰剂,持续24周。与安慰剂相比,在brensocatib两种剂量水平下,首次加重的时间显著增加,加重的风险在治疗期间更低,加重的年化率和严重加重的次数都更低[31]。与1期研究一样,brensocatib治疗组角化过度的发生率高于安慰剂组[31]。
Brensocatib正处于临床开发的后期阶段。然而,根据brensocatib的已发表数据[32],本文的数据表明,BI 1291583也可能是治疗慢性炎症性肺病(包括支气管扩张)患者的有希望的候选药物。我们发现BI 1291583抑制重组人CatC, IC50为0.9 nM;brensocatib的公布值为4.0 nM[32]。此外,我们在与BI 1291583相同的条件下对INS1007 (brensocatii的活性成分)进行了内部分析,在体内小鼠模型中检测了NE在U937细胞中的抑制作用,以及NE在血浆和骨髓中的抑制作用和分布(见附加文件1)。在该分析中,INS1007抑制U937细胞中活性NE的产生,IC50为64 nM;在这里展示的研究中,BI 1291583的值为0.7 nM。在LPS刺激小鼠模型中,INS1007在BI1291583剂量下(0.1、0.5和5 mg/kg)对BI1291583的NSPs有统计学显著抑制作用。总体而言,与本研究中报道的BI 1291583相比,INS1007对NE激活的抑制水平较低(附加文件1,图AF3)。在最高剂量(5mg /kg)下,与对照相比,INS1007对BALF中性粒细胞中NE活化的抑制率高达76%。在此剂量下,BI1291583显示出99%的NE活性抑制(附加文件图AF4)。在0.1 mg/kg的低剂量下,BI 1291583具有90%的抑制作用,而相同剂量的INS1007则没有抑制作用,这与体外药效一致。同样,在0.1 mg/kg、0.5 mg/kg和5 mg/kg剂量后约5小时的INS1007暴露分析显示,与我们在这里报道的BI 1291583 (INS1007分别为28、4和2)相比,骨髓-血浆暴露比明显降低;对于BI 1291583,分别为122,81和32)(附加文件图AF5)。
总的来说,来自INS1007内部分析的数据加强了BI 1291583将成为治疗支气管扩张的有希望的候选药物,具有高骨髓-血浆分布比,在U937细胞和体内均具有高疗效,并且非常低的有效血浆浓度,表明高靶室疗效。
在本研究中,我们展示了BI 1291583在小鼠模型中的骨髓到血浆分布。为了调查物种间暴露的差异,我们在单次口服剂量后对小鼠和大鼠进行了单独的比较动力学研究。在这两个物种中,我们观察到BI 1291583快速分布到骨髓中,并缓慢消耗(附加文件图AF6)。同样,即使在低剂量下,也观察到较高的骨髓与血浆暴露比,物种之间没有明显差异。这些数据表明BI 1291583在体内快速分布到靶组织中,并且补充了本研究中2天治疗假期方案和连续11天给药后的体内观察结果。
CatC在维持足底和掌表皮表面结构完整性方面的作用被认为是通过在角质形成细胞中加工角蛋白来实现的[33]。brensocatib一期研究中剂量依赖性皮肤事件的观察结果支持了这一观点[30]——这些事件发生的相对速度与NE活性的动态无关。此外,在不可逆CatC抑制剂GSK2793660的1期研究中[34],观察到明显的皮肤脱屑事件以及对下游NSPs的抑制不足,导致试验终止。我们认为,在我们的研究中观察到BI 1291583在骨髓中的优先分布可能会在随后的临床试验中最大限度地减少皮肤事件。
支气管扩张患者加重期痰PR3水平升高已被证实与NE同时发生[20];同样,CatG也与支气管扩张伴NE的发病机制有关[21]。因此,我们发现BI 1291583在体内产生活性PR3和CatG的剂量依赖性显著降低表明,上游抑制CatC,以及由此产生的广泛抑制NSPs,可能进一步增加支气管扩张患者的有益治疗潜力。
结论
本研究表明BI 1291583是一种可逆的、高效的、高选择性的CatC抑制剂,具有改善气道中由不受控制的NSP活性介导的中性粒细胞炎症和组织破坏的潜力。该临床前研究结果支持BI 1291583在支气管扩张患者中的进一步临床研究。
下载原文档:https://link.springer.com/content/pdf/10.1007/s00011-023-01774-4.pdf
为您推荐:
- 谁是伊斯坦布尔袭击的幕后黑手? 2025-04-26
- 渝贵高铁:穿越山川的飞龙,重塑西南地区的交通格局 2025-04-26
- 新哥斯拉电影片段显示怪兽长出尖刺并将尾巴武器化 2025-04-25
- 购买Havells印度;LKP Research的目标是1453卢比 2025-04-25
- 一家德国初创公司计划将养殖的海鲜带到餐桌上 2025-04-25
- 深度解析马自达六:驾驶体验与设计理念的完美融合! 2025-04-25


